Martin-chasseur oreillard
Cittura cyanotis - Sulawesi Lilac Kingfisher
Description de la famille
La famille des Alcédinidés, forte de 19 genres et 116 espèces, occupe tous les continents, excepté bien sûr l'Antarctique.
La taille de ses représentants va de celle d'un moineau à celle d'une corneille. La majorité fréquentent les milieux aquatiques et leurs abords, les autres étant plut... lire la suite
Identification
Ce martin-chasseur possède un dessus brun-olive, une queue couleur châtain, un puissant bec rouge. Le sourcil, la gorge et la poitrine sont lilas chamoisé. Les ailes présentent une combinaison de bleu foncé et de noir. L'épaule est traversée pour une longue rayure chamois blanchâtre. Les parties inférieures sous la poitrine affichent une coloration roux pâle. On peut parler d'un léger dimorphisme sexuel : les mâles présentent en effet un trait oculaire bleu foncé, ainsi qu'une partie antérieure de l'aile de la même couleur. Chez la femelle, ces mêmes parties sont noirâtres. Le juvénile est assez semblable aux adultes mais avec un plumage plus terne et un bec brun grisâtre.
Indications subspécifiques espèce monotypique
Noms étrangers
- Sulawesi Lilac Kingfisher,
- Martín cazador de Célebes,
- martim-caçador-orelhudo,
- Blauohrliest,
- kékfülű halción,
- Blauwoorijsvogel,
- Martin pescatore lilla,
- lilakindad kungsfiskare,
- Harlekinisfugl,
- rybárikovec maskový,
- ledňáček modrouchý,
- Maskeisfugl,
- celebesinsinikalastaja,
- alció orellut de Sulawesi,
- liliouch (płowy),
- zakrinkani lovač,
- Синеухий зимородок,
- Raja-udang pipi-ungu,
- アオミミショウビン,
- 苏拉蓝耳翠鸟,
- lilakindad kungsfiskare,
- 蘇拉藍耳翠鳥,
Habitat
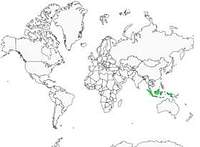
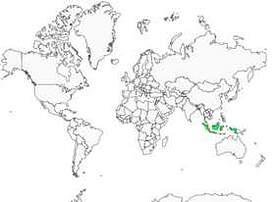
Le martin-chasseur oreillard est strictement limité au nord, à l'est et au centre de Sulawesi, en Indonésie, où il fréquente les forêts primaires et les peuplements secondaires bien régénérés, du niveau de la mer jusqu'à 1000 mètres d'altitude. Il est absent du sud de l'île. La sous espèce 'shanghirensis' est présente dans les îles voisines de Sangihe et de Talaud. Bien que restreinte, cette aire de distribution est apparemment très fragmentée. Cet oiseau est peu commun car il a dû subir l'exploitation intensive et la destruction de son habitat au cours des dernières décennies, ce qui a provoqué un indiscutable déclin de l'espèce.
Comportement traits de caractère
Le martin-chasseur oreillard mène généralement une existence solitaire. Très discret et rarement entendu, il se perche silencieusement à faible hauteur et peut rester pratiquement immobile pendant de longs moments sur une mince branche d'arbre attenante au tronc dans l'étage moyen et bas de la végétation, attendant le passage d'une proie à terre. C'est de cette position qu'il plonge vers le sol pour la capturer. Il se tient plus haut quand il crie. Son cri est une serie de 3 à 4 notes flûtées assez aiguës. Il émet également un 'kou-kou-kou' rapide que l'on peut comparer au cri d'un faucon, d'un coucou ou d'un tanysiptera et un 'kebekek' délivré en série à cinq ou six reprises.
Alimentationmode et régime
Comme la plupart des martins-chasseurs, son alimentation n'est pas dépendante des milieux aquatiques. Il se nourrit d'arthropodes (mille-pattes) et de petits reptiles qu'il chasse à l'affût. Cependant, sa principale ressource est constituée de gros insectes : mantes, cigales, sauterelles, cicadelles et coléoptères.
Reproduction nidification
Le nid, le comportement territorial et le mode de reproduction de l'oreillard sont pratiquement inconnus. Cependant, tous les autres grands martins-chasseurs qui vivent dans l'île de Sulawesi et partagent des territoires plus ou moins analogues (Martin-chasseur moine, martin-chasseur royal, martin- chasseur gurial, Martin-chasseur violet) creusent leur nid dans un talus meuble ou dans une termitière arboricole.
Menaces - protection
Statut de conservation IUCN
mineure
à l'état sauvage
menacé
évalué
Références utilisées
- IOC World Bird List (v14.2), Gill, F and D Donsker (Eds). 2024-04-18.
Autres références utiles
- Accipitriformes
- Aegotheliformes
- Ansériformes
- Apodiformes
- Aptérygiformes
- Bucérotiformes
- Caprimulgiformes
- Cariamiformes
- Casuariiformes
- Charadriiformes
- Ciconiiformes
- Coliiformes
- Columbiformes
- Coraciiformes
- Cuculiformes
- Eurypygiformes
- Falconiformes
- Galliformes
- Gaviiformes
- Gruiformes
- Leptosomiformes
- Mesitornithiformes
- Musophagiformes
- Nyctibiiformes
- Opisthocomiformes
- Otidiformes
- Passériformes
- Pélécaniformes
- Phaethontiformes
- Phoenicoptériformes
- Piciformes
- Podargiformes
- Podicipédiformes
- Procellariiformes
- Psittaciformes
- Pterocliformes
- Rhéiformes
- Sphénisciformes
- Steatornithiformes
- Strigiformes
- Struthioniformes
- Suliformes
- Tinamiformes
- Trogoniformes




 Fiche créée le
Fiche créée le